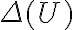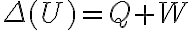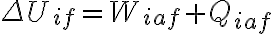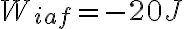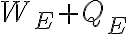Buenas,
Algo en mi razonamiento está mal pero no logro darme cuenta qué es. Plantee la primer ley para poder encontrar  de la forma
de la forma 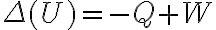 . El signo negativo en
. El signo negativo en  porque se trata de calor que el mismo fluye del sistema al entorno, dado que se se nota una baja en la temperatura del sistema. Por el otro lado, el signo de
porque se trata de calor que el mismo fluye del sistema al entorno, dado que se se nota una baja en la temperatura del sistema. Por el otro lado, el signo de 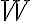 es positivo porque la letra dice que lo recibe, además se puede notar que hay un disminución de volumen.
es positivo porque la letra dice que lo recibe, además se puede notar que hay un disminución de volumen.
Razonando de esa manera no llego al resultado correcto, agradecería que me marcaran el error.
Saludos y gracias.