Hola, tengo una duda sobre el la parte b de este ejercicio. Yo calcule el Δs del hielo, pero luego para plantear el Δs del universo, necesito el Δs del ambiente. Dice que tome como despreciable el intercambio de calor con el ambiente, pero dentro del Δs del universo, tendría que tener en cuenta el Δs del lago no? Traté de calcularlo, pero no sabia como tomarme el proceso que le sucede, porque su temperatura se mantiene constante, pero no tengo el volumen final ni inicial como para plantear el calor de un proceso isotérmico. Pensé en que esta actuando como reserva térmica, pero no se como plantear el Q con los datos dados. Gracias
Hola Ayelén.
En este ejercicio, cuando nos dicen que despreciemos el intercambio de calor con el ambiente se hace referencia al intercambio de Q con todo lo que no es el lago. Es decir, que todo el calor entrante al hielo es calor saliente del lago. El hielo es muy pequeño en comparación con el lago, por lo tanto el calor saliente del lago no va a afectar la temperatura de éste y, como bien decís, se puede considerar al lago como una reserva térmica. Aquí estamos trabajando con un líquido, no con un gas, por lo que el proceso que sufre se da más o menos a volumen constante y a presión constante. Es por eso que cuando trabajamos con líquidos y sólidos usamos un solo calor específico, en lugar de los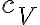 y
y 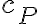 que usamos con los gases.
que usamos con los gases.
Ahora hay que recordar que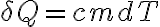 cuando tenemos un cambio de temperatura, con
cuando tenemos un cambio de temperatura, con 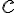 el calor específico másico y
el calor específico másico y 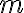 la masa de sustancia que cambia de temperatura, y que
la masa de sustancia que cambia de temperatura, y que 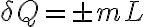 cuando tenemos un cambio de fase, con
cuando tenemos un cambio de fase, con 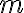 la masa que cambió de fase y
la masa que cambió de fase y 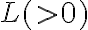 el calor latente asociado al cambio de fase. De aquí podemos determinar el calor intercambiado y el cambio de entropía.
el calor latente asociado al cambio de fase. De aquí podemos determinar el calor intercambiado y el cambio de entropía.
Espero que esto haya aclarado la duda.
Saludos.
En este ejercicio, cuando nos dicen que despreciemos el intercambio de calor con el ambiente se hace referencia al intercambio de Q con todo lo que no es el lago. Es decir, que todo el calor entrante al hielo es calor saliente del lago. El hielo es muy pequeño en comparación con el lago, por lo tanto el calor saliente del lago no va a afectar la temperatura de éste y, como bien decís, se puede considerar al lago como una reserva térmica. Aquí estamos trabajando con un líquido, no con un gas, por lo que el proceso que sufre se da más o menos a volumen constante y a presión constante. Es por eso que cuando trabajamos con líquidos y sólidos usamos un solo calor específico, en lugar de los
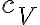 y
y 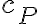 que usamos con los gases.
que usamos con los gases.Ahora hay que recordar que
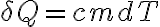 cuando tenemos un cambio de temperatura, con
cuando tenemos un cambio de temperatura, con 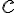 el calor específico másico y
el calor específico másico y 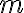 la masa de sustancia que cambia de temperatura, y que
la masa de sustancia que cambia de temperatura, y que 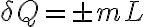 cuando tenemos un cambio de fase, con
cuando tenemos un cambio de fase, con 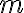 la masa que cambió de fase y
la masa que cambió de fase y 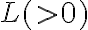 el calor latente asociado al cambio de fase. De aquí podemos determinar el calor intercambiado y el cambio de entropía.
el calor latente asociado al cambio de fase. De aquí podemos determinar el calor intercambiado y el cambio de entropía.Espero que esto haya aclarado la duda.
Saludos.
