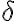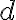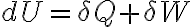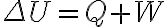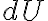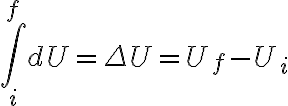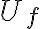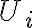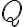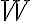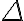Hola.
Los símbolos đ o
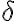
se utilizan para denotar diferenciales inextactos, a diferencia de
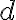
que se utiliza para los diferenciales exactos. El diferencial inexacto nos indica que la cantidad (en este caso calor o trabajo) depende del camino o del
proceso por el que el sistema va de estado inicial a estado final.
Al integrar la expresión diferencial de la primera ley
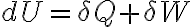
para cierto
proceso que siguió el sistema, obtenés la expresión integrada de la primera ley:
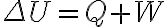
. Acá podés ver cómo al integrar
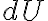
, entre el estado inicial y final del sistema, queda
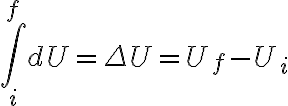
, donde
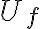
es la energía interna asociada al estado final del sistema y
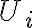
es la energía interna inicial del sistema. La energía interna es una función de estado, esto quiere decir que podemos asociar un valor de energía interna a un estado dado del sistema y además el cambio de energía interna de un sistema durante un
proceso no depende del
proceso seguido, solo depende del estado inicial y del estado final del sistema. Por otro lado, en la expresión integrada de la primera ley, podés ver que ni delante de
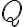
, ni delante de
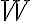
hay un
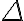
, esto es justamente porque tanto el calor como el trabajo para un sistema dependen del
proceso o camino por el que se llevó al sistema desde el estado inicial al estado final. No se le puede asociar un valor de calor o de trabajo a un estado dado del sistema, sí al
proceso, y es necesario conocer el
proceso para determinar el calor o el trabajo. Por ejemplo, que el trabajo depende del
proceso es fácil de ver gráficamente en un diagrama P-V: el sistema se puede mover desde el mismo estado inicial al mismo estado final por diferentes caminos que evidentemente tienen asociadas diferentes áreas bajo las curvas que los representan.
Espero haber aclarado tu duda.
Saludos.