Las cosas por su nombre: Entalpía
Las cosas por su nombre: Entalpía
En este documento presentaremos los procesos que sufren las sustancias (todas) en sistemas cerrados, cuando están sometidas a una presión externa constante.
Todos los sistemas cerrados verifican el 1er Principio de la Termodinámica:
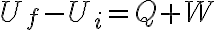
¿Qué tienen en común todos los sistemas que evolucionan a presión externa constante? Que el trabajo que realiza la presión externa está dado por:
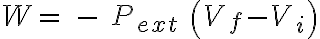 .
.
Entonces, como es fácil ver:
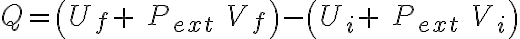 .
.
Definiendo entalpía como H = U + P V, observamos que, en el caso en que el proceso sea a presión constante:
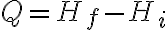 .
.
¿Por qué definimos entalpía? Porque, al igual que la energía interna, la entalpía es una propiedad de la sustancia. Entre dos puntos de equilibrio, siempre se tiene la misma variación de entalpía.
Porque, además, eso nos permite precisar la definición de:
(1) calor específico a presión constante 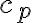 , como la variación de entalpía de 1,0 kg de la sustancia (todas) cuando aumenta su temperatura en 1,0 K, al sufrir un proceso a presión constante; lo cual es posible si la sustancia no cambia de fase.
, como la variación de entalpía de 1,0 kg de la sustancia (todas) cuando aumenta su temperatura en 1,0 K, al sufrir un proceso a presión constante; lo cual es posible si la sustancia no cambia de fase.
(2) calor latente o entalpía de transformación, como la variación de entalpía de 1,0 kg de sustancia cuando cambia de fase, al sufrir un proceso a presión constante.
