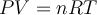Glosario y definiciones
Glosario y definiciones
Algunas definiciones y términos usados en el curso de Física 2
Navegue por el glosario usando este índice.
Especial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | Ñ | O | P | Q | R | S | T | U | V | W | X | Y | Z | TODAS
E |
|---|
Ecuación de estadoCualquier ecuación que relacione la presión, la temperatura y el volumen específico de una sustancia (inverso de la densidad) se denomina ecuación de estado. Las relaciones de otras propiedades que comprenden otras características de una sustancia en estados de equilibrio, también se conocen como ecuaciones de estado. Una ejemplo es la ya conocida y muy utilizada ecuación para un gas ideal, | ||
entropíaLa entropía se puede definir como una propiedad de una sustancia de acuerdo a la relación: 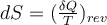 Observe que la entropía se define en términos de un proceso reversible, es una propiedad extensiva y, al igual que las otras propiedades, tiene valores fijos en estados fijos. | ||
Equilibrio termodinámico Situación en la cual se dan en un sistema cuatro tipos de equilibrio:
| ||